Luft
Lektionsplanering
Läxorna
Ett ungefärligt läxschema innebär att följande avsntt ska vara inläst till följande dagar:
7B: 4.1 - torsdag v 13, 4.2 - torsdag v 14, 4.3 - måndag v 15, 4.4 - torsdag v 15, 4.5 - torsdag v 17, 4.6 - måndag v 18.
7F: 4.1 - torsdag v 13, 4.2 - tisdag v 15, 4.3 - torsdag v 15, 4.4 - tisdag v 17, 4.5 - torsdag v 17, 4.6 - tisdag v 18.
Det kan alltid hända att någon lektion går bort på grund av oförutsedda händelser men det ska förhoppningsvis inte rubba schemat. Om du är frånvarande någon lektion så förbereder du naturligtvis läxan ändå. Om du vet att du kommer att få ont om tid någon vecka bör du plugga i förväg.
Vi kommer att avsätta gott om lektionstid för att göra testa-dig-själv-frågorna.
Prov. 7B och 7F har prov torsdag 5 maj, v 18. 7F
lektion 1 - Böcker, läxa 1



Böcker
Dela ut böcker.
genomgång
- Arbetsplan
- Diskussion kring uppslaget sid 52-53 i Spektrum kemi.
- Översikt över kursen.
Uppgift: Först bloggar de svar på rågor som vanligt. De som blir klara får läsa texter på webben.
läxa
Läxa är att läsa kap 4.1 till på torsdag. Sidorna 54-57 i Spektrum kemi-boken. Sid 31-32 i Lightboken
Luften
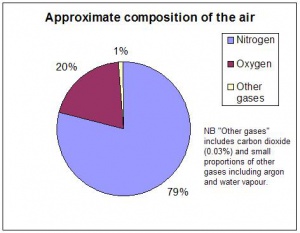
I luften finns det mest kväve och ganska mycket syre. Ungefär en femtedel är syre. Mer exakta siffror är att luften innehåller 78 % kväve och 21 % syre,
Dessutom finns det koldioxid som kommer från utandningsluft och förbränning, mm. Andelen koldioxid är bara 0,04 %.
Film 1: Dagens molekyl koldioxid.
Luften innehåller även ädelgaserna argon, 0,93 % och neon. Alla dessa gaser är blandade med varandra. Syremolekyler, kvävemolekyler och alla andra gasmolekyler far runt kors och tvärs och helt blandade med varandra. men det finns förstås flest kvävemolekyler.
Övriga gaser i mycket små mängder är metan, kolmonooxid och dikväveoxid.
luften innehåller mellan 0-4 5 vattenånga men eftersom det varierar så tar man inte med vattenångan när man talar om andelar av olika gaser i luften.
Molekyler
En molekyl är två eller flera atomer som sitter ihop. Molekylerna i kvävgas har två kväveatomer som sitter ihop. Syrgasmolekylerna har också atomerna som sitter ihop två och två. Därför skriver man formlerna N2 respektive O2.
Atmosfären
Luften finns i ett tunt skikt runt jorden. Skiktet är tunt jämfört med jordens diameter som är drygt 10 000 km. Luftskiktet kallas för atmosfär. Atmosfären tar slut på cirka 100 km höjd. Luften i atmosfären hålls kvar runt jorden genom gravitationen som påverkar varje molekyl i luften. varje liten kvävemolekyl påverkas av jordens dragningskraft som drar den mot jordens centrum. Samma med syremolekylerna och alla andra molekyler. Molekylerna rör sig och krockar med varandra och det ger upphov till det lufttryck vi kan mäta. Ju längre från jorden desto svagare dragningskraft. Därför tunnas luften ut längre bort från jorden. Ett annat sätt att beskriva det är att luftens densitet minskar ju längre från jorden man kommer kommer. Eller uttryckt på ett annat sätt: Ju högre upp man kommer desto glesare är det mellan molekylerna.
Atmosfären är ett tunt skikt. består av syre och kväve. Syre 21 %. Kväve 78 %.
Syre till förbränning
Film 1: Dagens molekyl syrgas. Film 2: Efter exakt sex minuter kommer det klassiska testet på syrgas. I övrigt några mysiga forskare.
Det behövs syre för en förbränning. Om du blåser på glöden i en grill kan du få den att flamma upp. Om du tar bort syret kring en eld slocknar den. Det är så brandfiltar fungerar. Det finns ett test för att se om en gas är syrgas. Det går till så att man stoppar ner en glödande sticka i gasen som ska testas. Om det är syre börjar glöden brinna.
Det är på sätt och vis lagom med en femtedel syre i luften. Det räcker för att vi ska kunna andas och det gör att eldar brinner. Om vi hade mer syre i luften skulle eldar brinna mycket häftigare och bli farligare. Ett brandsläckningssystem i datorhallar sänker syrenivån till 10 %. Det släcker bränder men ger ändå tillräckligt med syre för att personalen ska överleva.
Syre lvsviktigt för allt levande.
Syret används vid järnframställning och papperstillverkning, i syrgasmasker och vid svetsning.
Syre gör att det rostar. Kallas oxidering.
Syre används till att bleka papper. Används vid svetsning.
Syrgas till bergsbestigare, dykare.
Scheele upptäckte syret.
Kväve
Gödning.
Kväve används exempelvis till handelsgödsel. Flytande kväve används till kylning.
nederbörd
vattenånga kan kondensera på partiklar och bli vattendroppar. regn och snö
Separera gaser
Man kyler dem till kokpunkten. Då blir gaserna flytande. men gaserna har olika kokpunkter och det gör att de blir flytande vid olika temeraturer. Därför kan man tappa av en gas i taget i flytande form medans resterande ämnen är i gasform.
Frågor till kapitel 4.1
- Berätta om gaserna i luften. Andelar och namn vill jag veta.
- Vad är atmosfären?
- Luft är tunnare på högre höjd. Varför då? Använd gärna densitetsbegreppet i din förklaring.
- Beskriv ett test som talar om ifall det är syrgas man testar.
- Vad används syrgas respektive kvävgas till?
Laborastion 1 - syre och kväve
Det är säkert bra om ni filmar demon och labbarna men framför allt ska ni blogga om dem. ni ska blogga fullständiga labbrapoporter.
Demo: tryck en bägare på en kork som flyter.
Laboration: 4.1 - 4.
Laboration: 4.1 - 5.
Lektion 2 - 4.2 - Ozon

En syremolekyl
Det finns praktiskt taget inga ensamma syreatomer som far omkringi luften. Så fort det bildas fria syreatomer kommer de att gå ihop och bilda molekyler. Två syreatomer som parar ihop sig kan dela på elektroner och då bildar de en stabilare enhet. Syremolekylen består i de flesta fall av två syreatomer som sitter ihop. men det händer att tre syreatomer går ihop och bildar en molekyl. En molekyl med tre syreatomer kallas för ozon. Ozonmolekylen har den kemiska beteckninge O3.
Ozon, O3, är en gas bestående av tre syreatomer per molekyl. Gasen är giftig och är en hälsofara när den förekommer på marknivå (se markozon), men högt upp i atmosfären fyller den en livsviktig funktion som avskärmare av skadlig UV-strålning, se ozonlagret.
I den fotokemiska processen, exempelvis när solens UV-strålar träffar syrgas (O2), bildas fritt syre (O1) ozon (O3).
En underlig doft som uppstår vid åska beror på ozon som bildats.
Ozonskiktet
Det bildas ozon högt upp i atmosfären. Flera mil upp i luften är det gott om ozon. Vi kallar det ozonskiktet. Ozonet bildas genom att solljuset slår sönder syremolekyler till fria syreatomer. De fria atomerna kan sedan slå ihop sig med en annan syremolekyl och bilda ozonmolekyler med tre syreatomer. Men samtidigt bryter solljuset sönder andra ozonmolekyler. Det är två processer som pågår samtidigt, en där det bildas och en där det förstörs ozon. Detta gör att det hela tiden finns lagom mycket ozon i atmosfären. Ozonet är bra där upp i atmosfären. Det tar bort mycket av det ultravioletta ljuset från solen. För mycket ultraviolett ljus kan ge oss sönderbränd hud och hudcancer.
Ozonhål
Minskningen av ozonhalten i atmosfären (beroende bland annat på de ökade industriutsläppen) har under de senaste decennierna lett till att så kallade ozonhål har börjat dyka upp över jordens polarregioner (Arktis och Antarktis).
Avgaserna som jetplan släpper ut förstör ozonskiktet genom att ozonet reagerar med avgaserna och bryter ned dem..
freon från kylskåp och sprejburkar bidrog till at förstöra ozonskiktet förr i tiden. nu är det förbjudet med freon i dessa produkter.
Ozonskiktet filtrerar bort all UVC-strålning och delar av UVB-strålningen, vilket minskar risken för skador på huden.
Marknära ozon
Ozon nere vid markytan är inte bra för miljön. Det skadar växter och djur. Människor kan få lungskador av ozon. Ozonet här nere bildas när bilavgaser utsätts för solljus. Det bildas också och vid blixtar vid åskväder.
Tillämpningar - teknisk användning - industriellt
Ozon är kemiskt sett mycket aggressivt och har en relativt stor teknisk användning. Den kan bland annat användas till ytterst snabb och effektiv blekning av kemiska pappersmassor, samt för sterilisering av vatten
lektion 3 - Jorden en biografi: Film hela lektionen
Film
Jorden en biografi - Luften och atmosfären, 50 min
OBS! Att SLI har en lärarhandledning med frågor till filmen.
laboration 2 - varmluftballnger
Soppåsar, varmluftspistol. värmeljus, tråd.
lektion 4 - Förhör 4.2 och genomgång 4.3
Läxförhör 4.2
- Beskriv ozonmolekylen. Vad har den för molekylformel?
- Vad används freoner till?
- Hur bildas marknära ozon och hur påverkar det oss?
- Vad är ozonskiktet och varför är det så viktigt?
- Varför har ozonskiktet blivit tunnare?
- Berätta hur ozonbalansen uppkommer.
X Du är uppfinnare och har hittat på ett nytt kemiskt ämne. Vad bör du tänka på för att undvika att det skadar miljön?
Genomgång 4.3 - Ädelgaser
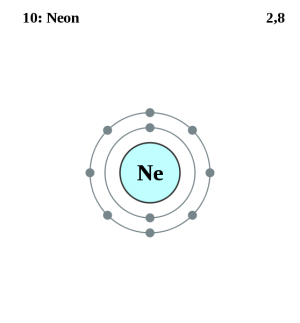
Mindre än 1 % av luften består av ädelgaser. Ädelgaserna är helium, neon, argon och krypton. Argon är vanligast i luften. Helium och neon är kanske de mest kända ädelgaserna. Krypton är troligen den minst kända av de fyra ädelgserna vi talat om här. dessuto finns...
Periodiska systemet Periodiska systemet är uppbyggt så att antalet elektroner ökar för varje steg åt höger på en rad. Längst till höger står ädelgaserna. Där har elektronerna fyllt ett lager runt atomen. Ett sådant lager kallas elektronskal. Nästa grundämne i serien har ytterligare en elektron men då börjar man fylla på i ett nytt skal och därför börjar man på en ny rad i det periodiska systemet. När två atomer bildar en molekyl hjälper de yttersta elektronerna till med att binda ihop atomerna. Detta fungerar om det finns luckor i det yttersta skalet för då kan atomerna dela elektroner med varandra och hjälpas åt att fylla ut luckorna. Då fungerar det som om atomen hade fullt i sitt yttre skal och det är ett slags idealtillstånd för atomen. Ädelgaser har redan fullt med elektroner i sittt yttre skal och därför behöver de inte hjälp med att fylla på. Det är därför ädelgaserna inte reagerar med andra ämnen. Att ädelgaserna inte reagerar med andra ämnen kallas för att de inte bildar kemiska föreningar. De heter ädelgaser för att de inte reagerar. Precis som att ädelmetallen guld inte reagerar med andra ämnen.
Ädelgaserna är obundna atomer. De sitter inte ihop med varandra i pas som till exempel syre gör.
Användningsområden En del äldre ljusreklamer kallas för neonskyltar därför att de lyser upp med hjälp av gasen neon.
Lysrör skapar ljus genom att ström går genom argon och kvicksilverånga. gaserna joniseras därmed och sänder ut vitt ljus. Lågenergilampor är en kompaktare variant av lysrör. Det mesta av effekten i en lågenergilampa blir ljus till skillnad från konventionella glödlampor som genererar mycket värme. Lågenergilampor måste källsorteras eftersom de innehåller kvicksilver som är farligt för miljön.
Den klassiska varianten av glödlampor har en glödtråd av metall som ger ljuset. Glödtråden skulle brinna av om det fanns syre i närheten. Därför behöver man skydda tråden med en gas som inte reagerar med metallen i glödtråden. Argon används som skyddsgas i gamla glödlampor.
Många tidiga ballonger och framför allt zeppelinarna lyftes av att de var fyllda med den lätta gasen väte. Tyvärr brinner vätgas med explosiv kraft och efter olyckor med bland annat Hindenburg började man använda helium i ballonger istället. De ballonger vi ser flyga över stan är varmlufballonger och har ingen speciell gas i sig. Partyballonger och väderballionger kan vara fyllda med helium.
Industriell användning
Skyddsgaser kallas det när man har en gas som ska hindra en kemisk process. Det kan vara luftens syre men vill hindra att komma åt det man håller på med. Om man exempelvis svetsar kan syret oxidera svetsfogen så att den blir ohållbar. När man tillverkar läkemedel är det viktigt att skydda den kemiska processen så att inte läkemedlet förstör. Både syre och kväve kan påverka tillverkningen av läkemedlet.
Lektion 5 - Film och frågor
Dagens lektionsinnehåll: Film om periodiska systemet samt läsa och blogga svar på instuderingsfrågor till kapitel 4.3 om ädelgaser.
Kemins värld del 1. Film om det periodiska systemet. det finns fler filmer om man söker på periodiska på SLI.
Lektion 6 - Lite film mm
Film
http://www.sli.se/prodinfo.asp?a=DVD%201088&page=default.asp&sid=d465715a-aa7d-437f-82bd-aa4b5c08947a&db=4&e=&g=012-016&w=syre&s=-1&p=1&st=0&sub=&ss=1&otyp=product&lev=&tlang=&slang= Fotosyntes - en livsviktig process - 12-18 år
Lektion 6 - Förhör 4.3 och genomgång 4.4
Läxförhör: 4.3
- Vad heter de fyra vanligaste ädelgaserna?
- Vad menas med att ädelgaserna är ”ädla”?
- Berätta om tre saker som man använder ädelgaser till.
- Vad menas med skyddsgaser? Kan du själv komma på några tillfällen när de kan vara användbara?
X Den första ädelgasen som upptäcktes var argon. Argon betyder ”trög” och ”lat” på grekiska. Försök förklara varför gasen fick det namnet.
Genomgång
Lektion 7 - Lite film mm
Film http://www.sli.se/prodinfo.asp?a=DVD%201110&page=default.asp&sid=d465715a-aa7d-437f-82bd-aa4b5c08947a&db=4&e=&g=012-016&w=koldioxid&s=-1&p=1&st=0&sub=&ss=1&otyp=product&lev=&tlang=&slang= Växthuseffekten- Klimatförändringar och global uppvärming
Kokosboll i vakuum, Årstaskolan.
Lektion 12 - Skriva i wikin
Datorövning: I wikin: En lista med viktiga begrepp och stödord i kursiv stil. Eleverna ska bygga meningar kring varje ord och hitta bilder som illustrerar. Rubbar och grupper om tre. Ett ord per grupp